我们通过一篇美国俄勒冈州立大学药学院的研究论文,讨论缓冲体系对mRNA-LNP的影响,供大家参考。

摘 要
该研究测试了三种常见生物缓冲液——HEPES、Tris和PBS——在单次冻融前后与DLin-MC3-DMA mRNA-LNP制剂的相容性。通过电子显微镜、差示扫描量热法和膜流动性分析发现,不同缓冲液使LNP形态发生了不同的结构变化。采用体外和体内模型测量mRNA转染效率,发现Tris或HEPES缓冲液中的LNPs具有更好的冷冻保护效果以及与PBS相比更高的转染效率。
1、缓冲体系可能对LNP的性质与稳定性有较大影响
近年来,脂质纳米颗粒(LNPs)作为治疗多种遗传疾病、疫苗和蛋白质替代疗法的非病毒核酸递送平台受到了广泛关注。新冠mRNA-LNP疫苗的全球成功凸显了基于LNP的核酸递送潜力。
LNP配方的优化取决于混合方法,速率,使用的溶剂,pH值中和和纯化过程。
虽然LNPs通常被认为是凝聚态疏水材料,但它们可以捕获大量的水,这取决于LNP的组分和其包载的mRNA分子。mRNA-LNPs水分含量可以高达30%,这表明LNP制剂中缓冲体系的选择可能会对LNP的形成、性质和稳定性产生巨大影响,尤其是考虑到mRNA-LNPs溶液需要在零度以下的温度下长期储存的情况。
缓冲液在冷冻时的结晶会严重影响生物制剂的性质,并会导致LNP破裂和聚集,这在最近的报道中得到了证实。此外,缓冲液在冻结时的一个特殊性质是诱导产生pH梯度。例如,常用的磷酸缓冲盐溶液(PBS)在冷冻时可以经历多达4个单位的pH变化。常见的糖类冷冻保护剂如海藻糖、蔗糖等可以一定程度上抑制这些影响,但无法完全消除。
据报道,磷脂头部基团也会与缓冲体系相互作用,导致脂质膜软化。
因此,LNPs可能高度敏感于pH和膜弹性的动态变化,如缓冲体系类别、离子强度或温度变化。
2、该研究中LNP配方及表征方法
将萤火虫荧光素酶(FLuc) mRNA用50 mM柠檬酸钠缓冲液(pH 4)和分子级水稀释,达到所需体积。将DLin-MC3-DMA、DSPC、胆固醇和DMG-PEG-2000溶解在总脂质浓度为5.5 mM的纯乙醇(摩尔比为50:10:38:1.5)中,以3:1的体积比(水/乙醇)和9 mL/min的总流速通过标准微流控混合制备LNPs。
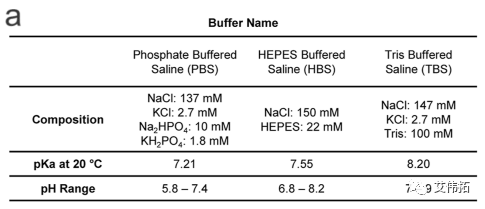
制备用于透析的HEPES、Tris和PBS(详见下图a,Tris即为Tris Buffer,HBS即为HEPES Buffer),其盐度为150 mM, pH为7.4。配制后,立即将LNPs转移到10个kDa MWCO盒中,并在各自的缓冲液中以1000倍的体积透析4小时和过夜。透析后,LNPs在Amicon Ultra离心过滤装置中以3000g离心浓缩,分子量截止为100 kDa(Millipore Sigma, Burlington, MA)。
使用Zetasizer Nano ZSP对LNPs进行了水动力尺寸、多分散性指数和表面zeta电位的表征。对于Zetasizer分析,LNPs在各自的缓冲液中稀释,得到三次测量结果。为了量化mRNA的包封效率和浓度,采用了改进的Quanti-iT RiboGreen RNA(Invitrogen)方案。
3、研究成果
3.1 缓冲液对LNP的形成和短期稳定性的影响可以忽略不计
通过标准的微流体混合程序制备含有FLuc mRNA的LNP。DLin-MC3-DMA、DSPC、胆固醇和DMG-PEG-2000脂质按50:10:38.5:1.5摩尔比混合,pH 4柠檬酸缓冲液中的mRNA溶液与乙醇脂质混合物的体积比为3:1,总流速为9 mL/min。然后将所得的LNP悬浮液分成三等份,分别与PBS、Tris或HEPES进行透析。
透析后,将LNPs浓缩,并通过动态光散射(DLS)和改进的核糖绿测定法进行分析。
DLS分析显示,三种缓冲液中LNPs颗粒大小几乎相同,约为70 nm,PDI约为0.05。
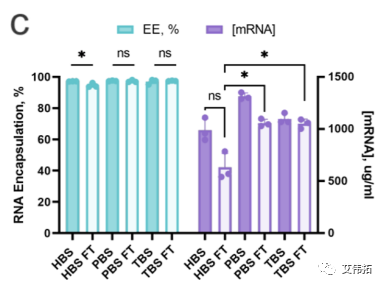
Zeta电位值表明,PBS和Tris配方的表面电荷略为负(约−3mV),HEPES配方的表面电荷为中性,三种缓冲液中包封率均为>92%。
LNP的冷冻透射电镜显微照片也没有显示任何显著的形态变化,这表明缓冲液对LNP的形成、形态或短期稳定性的影响可以忽略不计。
3.2 低温冻存复溶后,不同缓冲液中LNP关键表征出现差异
在- 20℃下保存三周后,将不同缓冲溶液中的LNPs在室温下解冻30分钟,立即用于研究。
①粒径
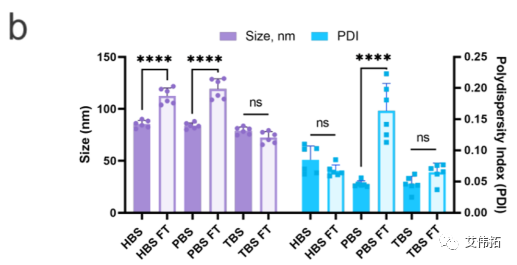
储存在HEPES和PBS中的样品在FT后的平均粒径增大了约50%,而储存在Tris中的LNPs的粒径减小了约10 nm。
②PDI
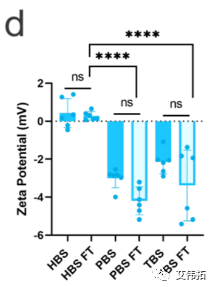
HEPES和Tris中LNPs的PDI在冻融前后基本保持一致,而PBS中LNPs在解冻后PDI增加了3倍(上图b)。FT后Zeta电位也略有下降(上图d)。
③LNP形态
LNP形态受到冻融的严重影响,冷冻透射电镜证实PBS缓冲液中的 LNP在大小上最多样化,并且显示出高度异质性的内部组织,以及颗粒聚集。这可能是脂质相和水相分离所导致。具体而言,PBS中的LNP包含典型的100 nm以下的致密LNPs,100~150nm的空脂质体样结构,以及不同粒径包载水相的LNPs,其中部分水相中含有mRNA。
DLS分析显示,Tris中的LNPs尽管观察到形态变化,但尺寸和PDI没有明显变化,这表明相比于PBS,Tris可能可以更大程度地抑制LNPs颗粒的聚集。
与新鲜LNPs相比,HEPES中的LNPs在冻融后出现独特的沙漏状结构,尺寸略大(见下图e)。在LNPs周围形成的水泡似乎缺乏mRNA,这可能表明HEPES可以影响mRNA周围脂质的堆积,例如,HEPES可以促进脂质与mRNA之间更强的静电相互作用——HEPES LNPs的zeta电位是真正的中性的,而PBS和Tris LNPs具有−2至−5 mV的轻微负电荷,这可能表明当HEPES存在时,mRNA电荷的中和作用更有效。
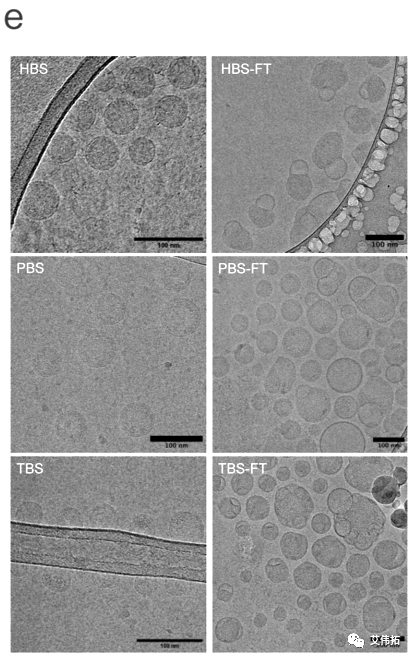
此外,基于冷冻显微图像研究了脂质膜厚度的变化。
平均而言,脂膜厚度在FT后增加了15%,表明膜水合作用增加。
更具体地说,冷冻后,Tris LNPs的脂膜厚度增加了约0.8 nm, PBS增加了约0.6 nm, HEPES LNPs增加了约0.2 nm。尚不完全清楚这些改变是否表明脂质膜成分发生变化或仅仅是水掺入的结果,但这些结果突出了解冻后LNPs的脂质膜发生了显著变化,且不同缓冲体系中变化程度不同。
以上实验结果表明,不同缓冲液对mRNA-LNPs的关键表征(形态、粒径、PDI,脂质膜厚度等)可以产生较大影响。
3.3 转染能力与内涵体逃逸的体外评估
①缓冲液影响LNP转染能力
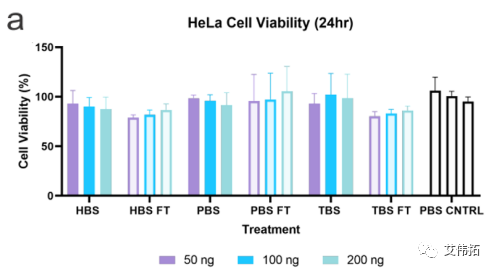
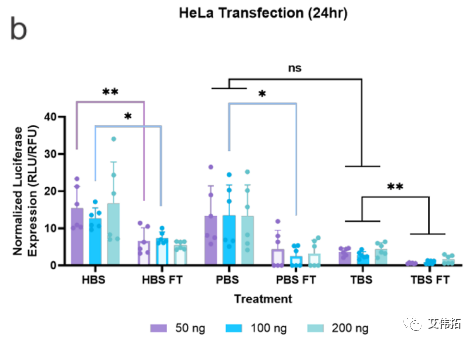
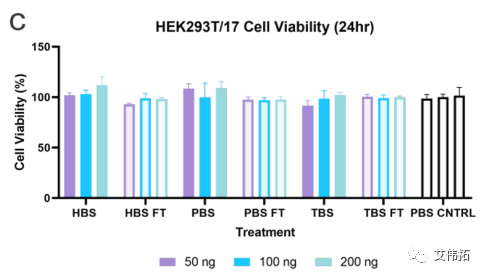
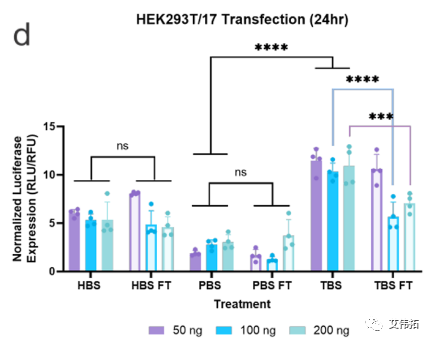
该研究评估了不同缓冲液中的LNPs的转染能力和内涵体逃逸的程度。分别用包封FLuc mRNA的LNPs处理hela和HEK293T/17(后者用Gal9-GFP报告系统修饰)两个细胞系,并在24小时后检测。无论使用何种缓冲液,细胞存活率均保持在80%(下图a,c)。转染评价表明,缓冲液的转染效率随细胞系的不同而变化。在HeLa细胞中,LNPs转染趋势为HEPES>PBS>Tris(下图b),而HEK293T/17细胞表现出Tris>HEPES>PBS的偏好(下图d)。
一般来说,所有的mRNA-LNP制剂在解冻后转染效果都有所下降。在HeLa细胞中,PBS LNPs的转染效率下降最为严重,在所有处理中平均下降4倍,而HEPES在所有处理中平均下降2倍(下图b)。对于HEK293T/17细胞系, HEPES和PBS LNPs均无统计学意义的下降,而Tris在100和200 ng时的LNPs分别下降了2 ~ 2.5倍(下图d)。
②缓冲液影响内涵体逃逸效率
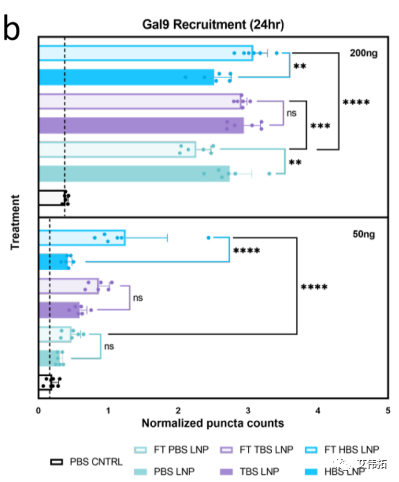
凝集素是一个与病原体入侵和免疫感知相关的糖结合凝集素家族。半乳糖凝集素如gal3、gal8和gal9从弥漫的细胞质表达重新分布到暴露的糖苷位点,这是由于内体内小叶暴露事件造成的,表明内涵体破坏。Gal9已被证明在报告细胞内涵体逃逸的检测中具有最高的信噪比。因此,可利用Galectin 9 (Gal9)- gfp 修饰的HEK293T/17细胞系,评估FLuc mRNA LNPs的内涵体逃逸情况。
低剂量处理(50 ng)在所有新鲜LNPs中几乎没有变化,HEPES LNPs在FT后表现出最高的Gal9募集和最显著的变化(2.6倍)。
高剂量(200ng)处理组中,冷冻前Tris LNPs诱导了最高的Gal9募集。不同缓冲体系中的LNP对FT的反应完全不同。PBS LNP减少了Gal9的招募,Tris LNPs几乎没有变化,HEPES LNPs增加了Gal9的招募。解冻后的HEPES LNPs内涵体逃逸的增加可能是低温透射电镜观察到的形态学变化的结果。LNP形态的变化导致体外转染的增加,因此HEPES可能促进了解冻后LNP形态的有利变化。
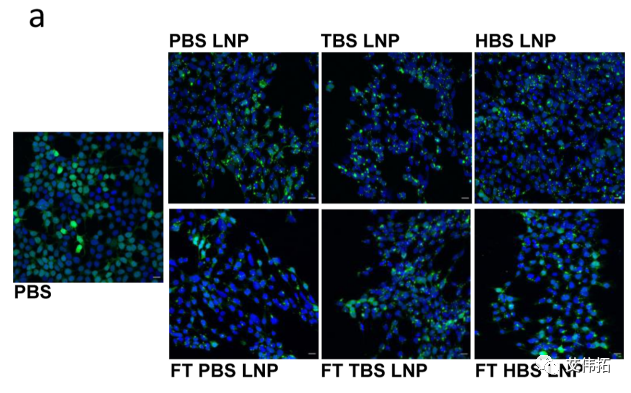
这些体外实验数据进一步支持了LNP缓冲液组成对冻融后转染效率的重要性,并揭示了细胞摄取的差异受到这些变化的影响。
3.4 体内成像评估mRNA表达情况
通过活体成像,探索了不同缓冲体系mRNA-LNP在体内的表达情况。将HEPES、Tris和PBS LNPs静脉注射到年龄匹配的雌性BALB/c小鼠中,比较荧光素酶的表达水平和器官特异性。在注射后4和24 h时间点测量新鲜和解冻的LNPs的生物发光信号。
在所有案例中,生物发光图像显示强烈的肝脏转染模式,与通常的LNP静脉注射制剂一致。
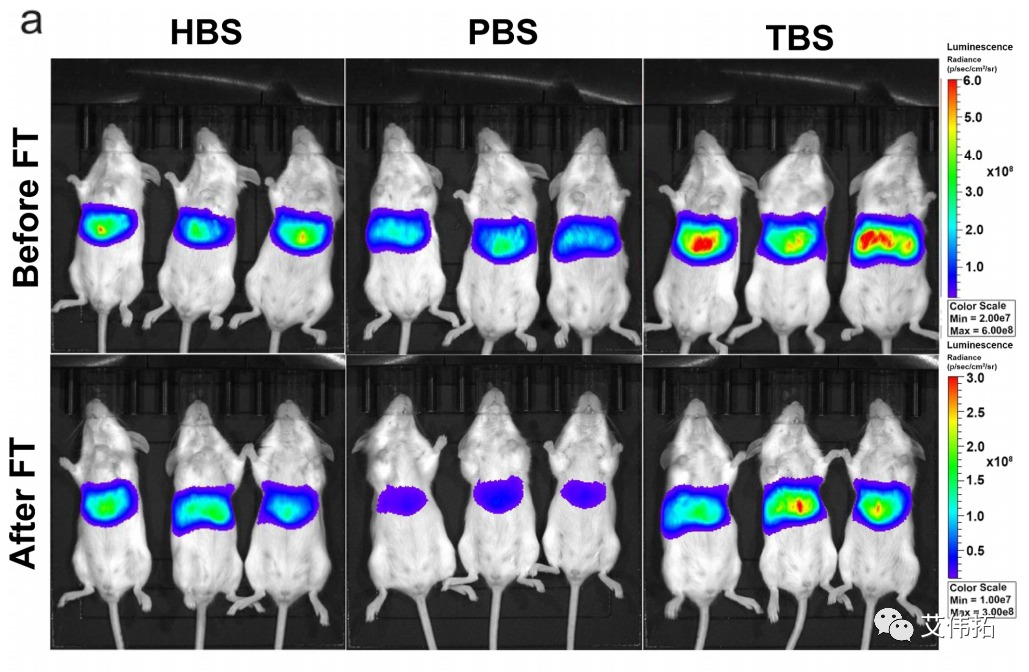
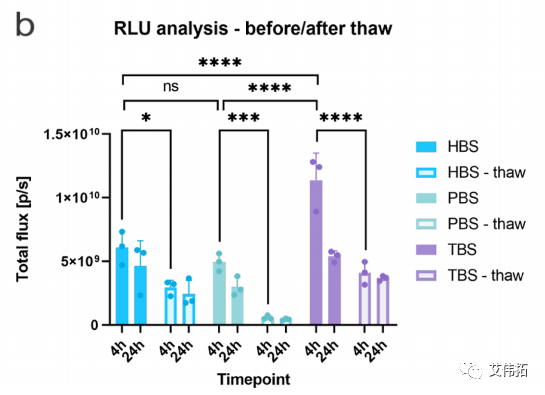
总体而言,HEK293T/17细胞系的体内转染趋势与体外观察到的相似(Tris > HEPES > PBS)。新鲜LNPs之间的交叉比较得出结论,与其他缓冲液相比,Tris组在给药后4小时增加了2倍。这种功效的增强可能是由于脂质膜上的水置换改善了apoe介导的摄取,正如脂质膜厚度减少所表明的那样。
然而,缓冲液导致了不同程度的转染损失。对于给药后4小时的FT组,HEPES显示总通量减少约2倍,Tris显示减少约3倍,PBS (LNP配方中最常见的缓冲液)导致总通量减少近9倍。
有趣的是,在24小时时间点,不同缓冲液样品之间mRNA表达水平没有统计学上的显著差异。这可能是LNPs在血液中不断循环,缓冲液作用减弱的结果。
总的来说,与先前的观察结果一致,mRNA的传递受到冻融过程的影响。缓冲液对体内给药效果的巨大影响表明,在LNP制备中选择适宜的生物缓冲液,或可为保持mRNA-LNP的理化性质及生物学活性提供显著优势。
4、结论
脂质纳米颗粒(LNP)通常通过透析或与生理缓冲液(如PBS)交换缓冲液来中和,纯化后可直接注射入生物体。此外,缓冲体系可以作为冷冻保护剂,减轻LNP制剂在低温储存时的稳定性问题。
值得注意的是,FDA批准的COVID-19疫苗Spikevax和Comirnaty使用不同的缓冲液,这表明不同的mRNA-LNP制剂可能对缓冲体系有不同的要求。(笔者注:Comirnaty上市后制剂处方中缓冲体系由PBS变更为了Tris,详细信息请参考:《Moderna:使用TRIS缓冲体系可提高mRNA稳定性》)
因此,为LNP制剂筛选适宜的缓冲体系是一个极具价值的研究课题。然而,缓冲体系对LNP的结构形态、包封率和转染效率方面的作用迄今尚未得到充分研究。
本文分享的研究中,使用常用阳离子脂质DLin-MC3-DMA制备mRNA-LNP,在-20℃低温冷冻3周,比较了LNP冻存前后的理化性质和生物学活性(体外+体内)。
结果表明,通过体外和体内转染衡量,在HEPES和Tris体系中的LNPs总体上优于PBS。与PBS相比,HEPES和Tris作为冷冻保护剂,可以在更大程度上保存LNPs的结构和mRNA的递送效率。
此外,储存在HEPES中的LNPs在FT循环后形成了独特的沙漏状结构,而Tris和PBS在冻融后都产生了高度聚集的结构。因此,HEPES可以为LNPs提供更好的保护,防止pH梯度急剧下降,防止LNP聚集,最终控制相分离过程。另一方面,使用Tris对转染特别有益,这表明缓冲盐等辅料在LNP制剂中的作用可能被大大低估了。
通过分享该研究,艾伟拓产品团队希望揭示LNP制剂处方研发过程中,缓冲体系选择的重要性,希望能够为广大核酸递送企业及相关从业者带来一定的参考。
未来,艾伟拓产品团队也会持续关注核酸递送制剂处方相关研究进展,包括不同剂型(如冻干剂型)、不同存储条件(如2~8℃冷藏存储)、不同LNP脂质组分及不同载荷等因素对LNP制剂辅料选择的影响。
